吴小华教授&李琎教授 | 卵巢癌维持治疗新纪元:从PFS获益走向OS时代
作者:吴小华 李琎 2024-08-09
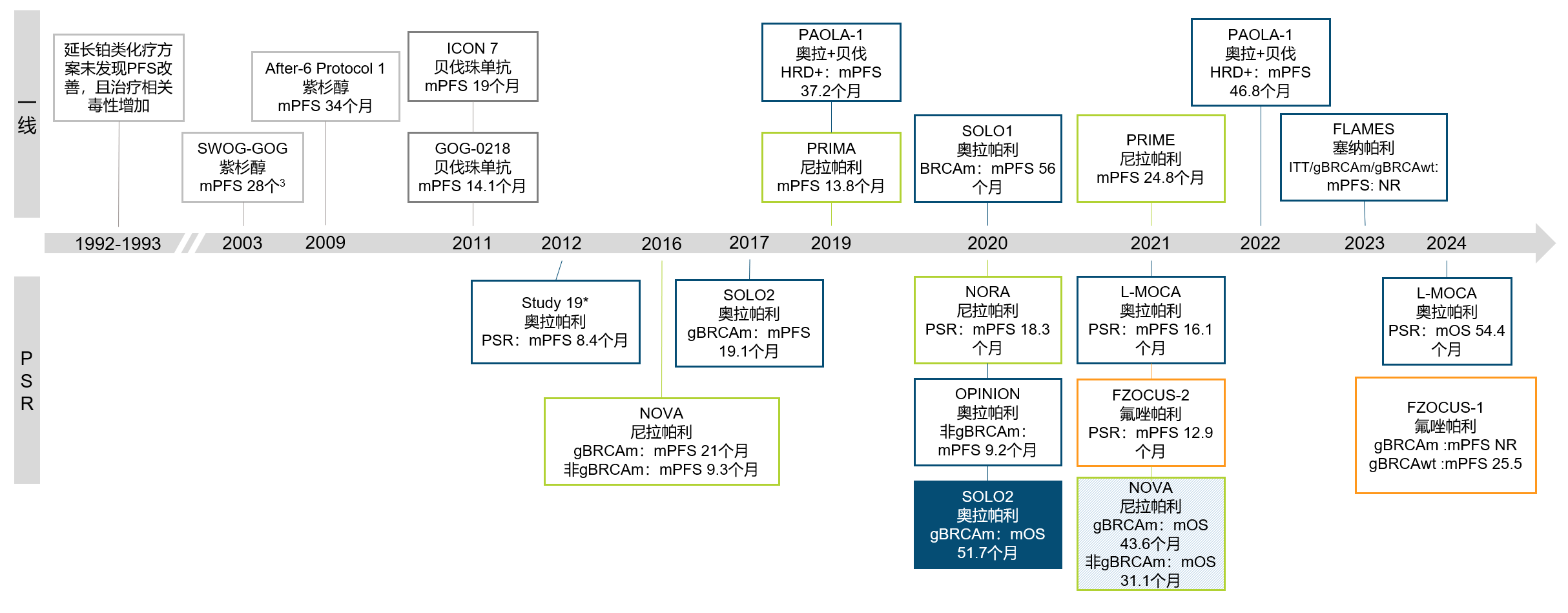
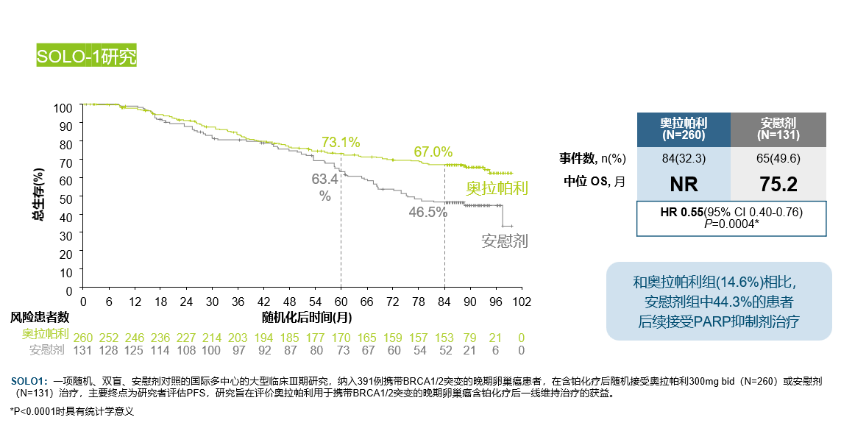
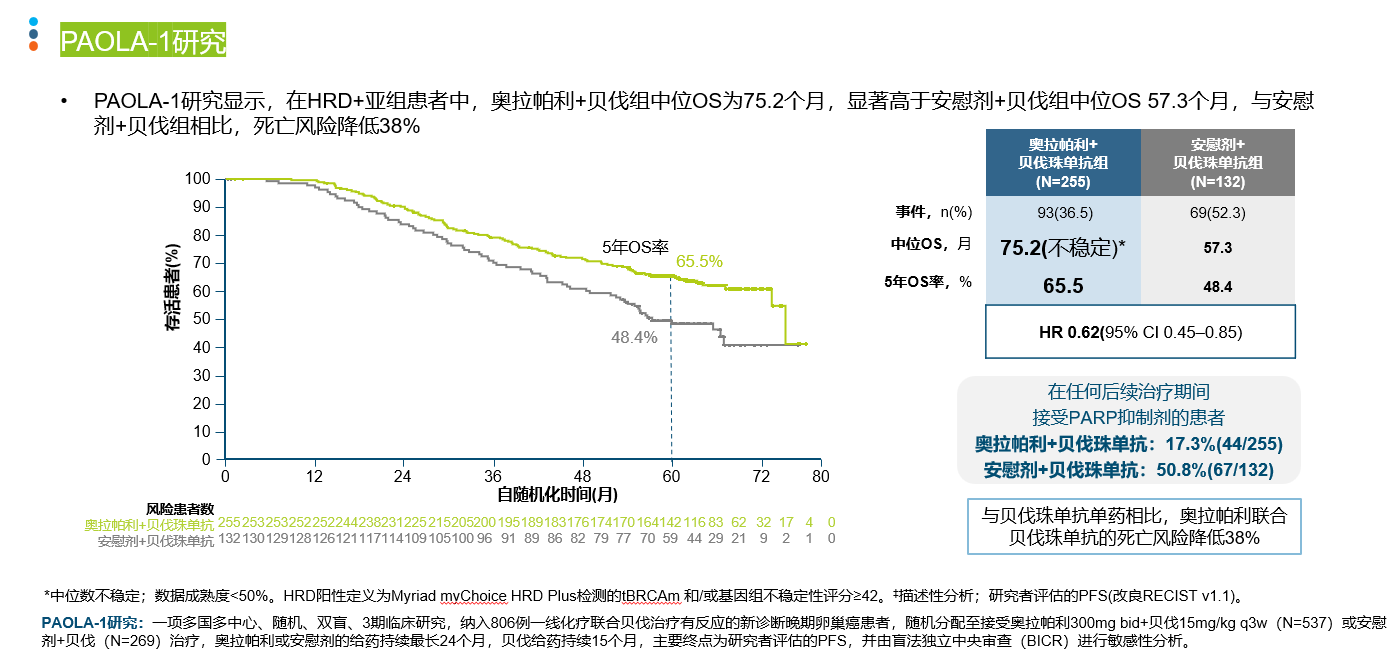
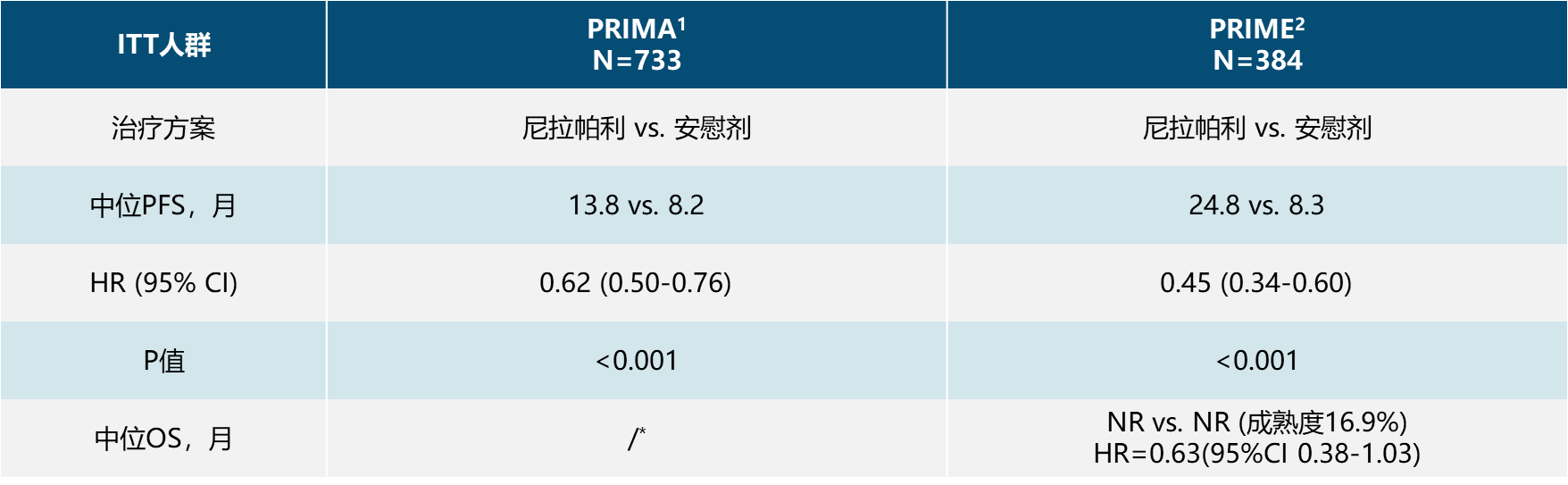
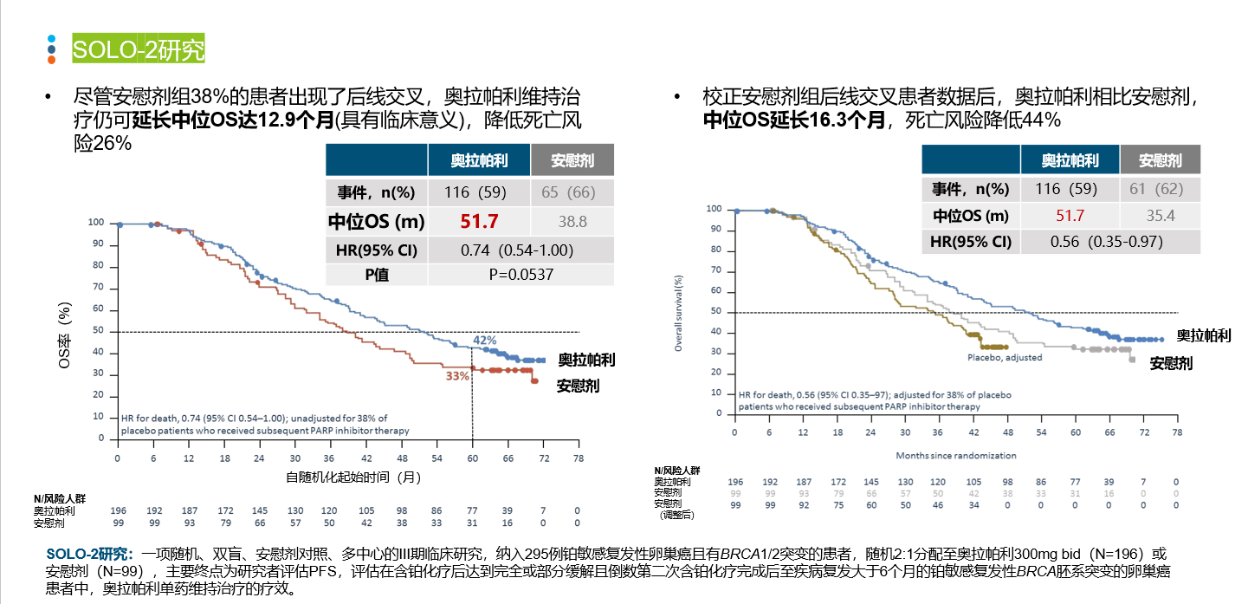
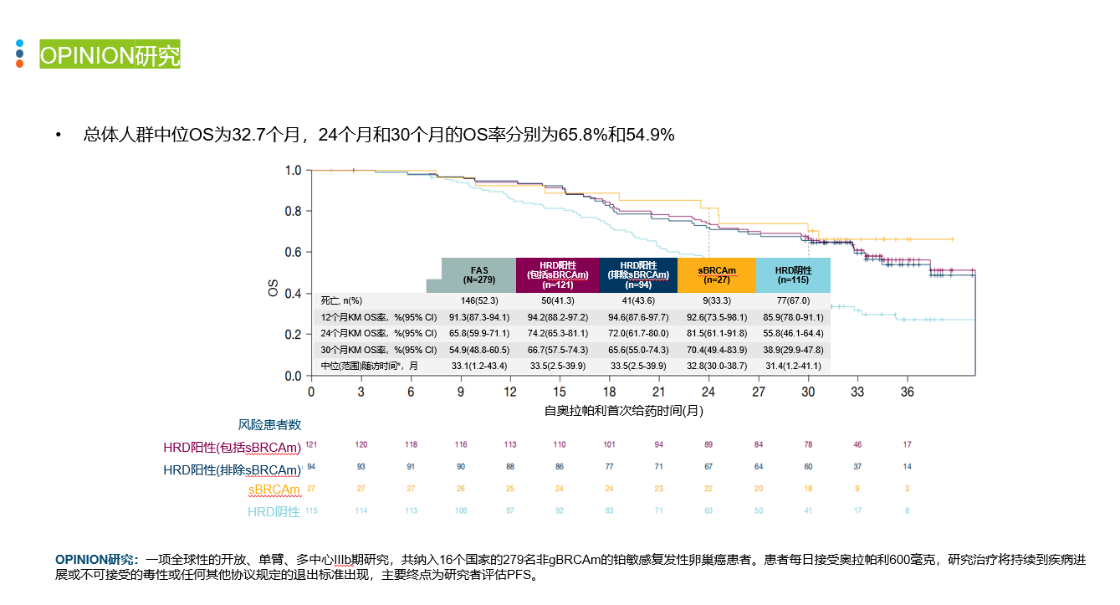
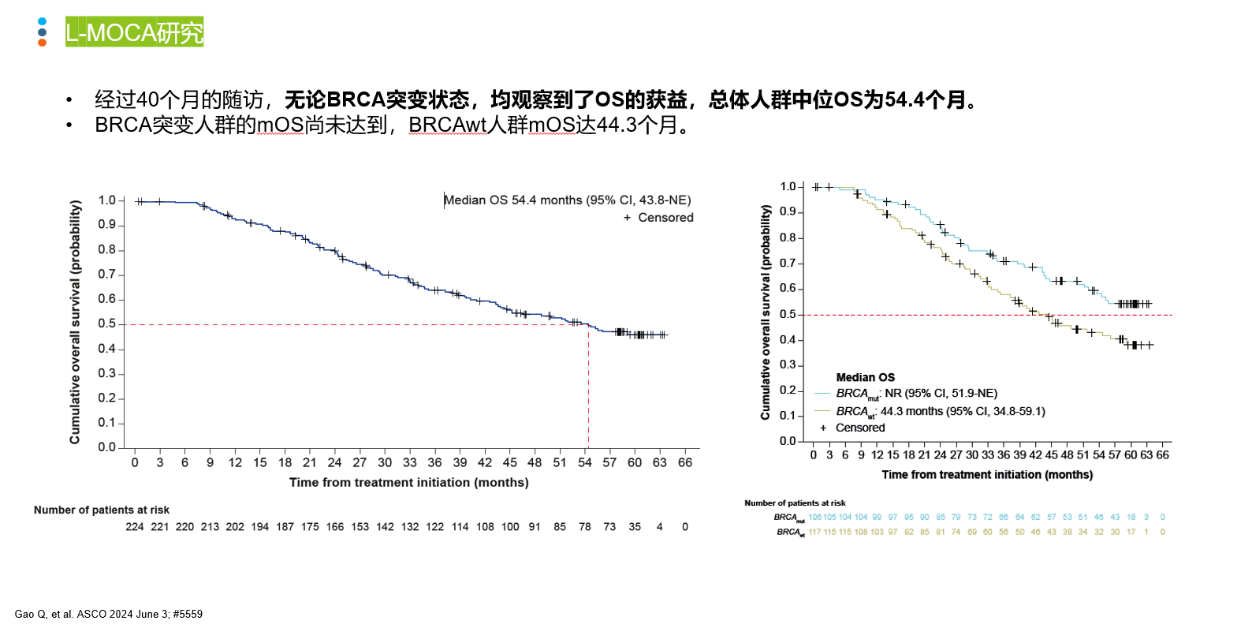
导语 1、延长生存是晚期卵巢癌维持治疗的关键目标。聚腺苷酸二磷酸核糖基聚合酶抑制剂(PARP抑制剂)出现之前,卵巢癌维持治疗未能带来全人群的生存获益。当药物能够兼顾有效性和安全性时,维持治疗的无进展生存期(PFS)的获益有可能转化为总生存期(OS)的获益。 2、在卵巢癌一线维持治疗领域,SOLO-1研究和PAOLA-1研究证实了奥拉帕利是目前在卵巢癌一线维持治疗领域有临床意义上OS获益的PARP抑制剂。 3、在PSR卵巢癌治疗领域,奥拉帕利的OS获益覆盖全人群。SOLO-2研究证实了对于具有BRCAm的铂敏感复发(PSR)卵巢癌人群,奥拉帕利具有临床意义上的OS获益的PARP抑制剂。L-MOCA研究证实无论BRCA基因状态均有OS获益,全人群数据达54.4个月。 卵巢癌是常见的妇科恶性肿瘤,也是最常见的癌症死亡原因。由于缺乏有效的早期筛查手段,患者就诊时多为晚期[1]。20世纪中晚期,治疗的主要手段是化疗,而晚期卵巢癌接受化疗后5年生存期仅为8.5% [2,3]。尽管最佳的减瘤手术和化疗能达到完全缓解,卵巢癌的5年复发率仍可达40%~75%[4]。 卵巢癌维持治疗是指卵巢癌完成既定的手术或化疗后达到最大限度临床缓解(完全或部分缓解)后,继续应用化疗药物或靶向药物进行的治疗,治疗的目的是延缓复发,延长PFS和OS,其中OS为唯一基于生存时间的终点,也是药物获批的金标准。在肿瘤药物中,也会使用PFS和客观缓解率(ORR)等早期研究终点代替OS,用以加速审批。当药物能够兼顾有效性和安全性时,PFS的获益有可能转化为OS的获益[5]。 此前对于卵巢癌维持治疗的探索发现,延长铂类化疗的治疗方案和延长紫杉醇药物周期的持续治疗不仅不能带来OS收益,且增加毒性事件[6]。尽管贝伐珠单抗维持治疗显示出PFS获益,但OS获益仅局限在高危人群中[7-10]。随着医学技术的发展和对卵巢癌的深入研究,如今,PARP抑制剂维持治疗已经在临床实践中获得广泛应用。时至今日,经过12年的探索,PARPi已成为卵巢癌维持治疗的标准方案。但在形形色色的PARP抑制剂研究中,并非所有的PARPi的PFS获益都能够转化为OS获益。本文将就PARP抑制剂引领卵巢癌维持治疗从PFS获益走向OS获益的历程进行深入讨论[6]。 PARPi维持时代:PARPi单药或联合维持治疗改变了晚期卵巢癌的治疗格局 PARP抑制剂在卵巢癌维持治疗领域的探索,最早可以追溯到2012年的Study19研究。Study 19首次证实无论BRCA突变与否,相较于对照组,奥拉帕利可显著降低PSR卵巢癌疾病进展或死亡风险65% [11]。此后PARPi在晚期一线和PSR卵巢癌维持治疗领域不断进行探索(图1)。在SOLO-1研究中,BRCAm患者使用奥拉帕利单药治疗的中位PFS达到 56个月。PAOLA-1研究同源重组修复缺陷(HRD)亚组中,奥拉帕利联合贝伐珠单抗带来的中位PFS较安慰剂组延长 [46.1个月(奥拉帕利联合贝伐珠单抗 )vs 17.6个月(贝伐珠单抗)],5年PFS 达46.1%, 高于贝伐珠单抗组的19.2%[12,13]。 图1. PARP抑制剂在晚期一线和PSR 卵巢癌维持治疗领域研究一览 而对于PSR 卵巢癌患者而言,无论基因状态如何,奥拉帕利用于PSR患者均有疗效获益。2017年,SOLO-2研究公布部分结果,研究显示在BRCAm PSR患者中,奥拉帕利单药与安慰剂组中位PFS分别为 19.1个月 vs 5.5个月;特别值得一提的是L-MOCA研究,该研究主要纳入亚洲人群,其中91.5%为中国患者,35.7%患者接受了2线以上化疗。L-MOCA研究在2022年公布了PFS数据,结果显示无论基因状态如何,奥拉帕利用于PSR卵巢癌患者均有疗效获益。总人群的中位PFS达到16.1个月,其中既往接受2线化疗患者中,BRCAwt患者的中位PFS达到14.1个月。PARP抑制剂对于卵巢癌患者的PFS获益可参见图2.[14-16]。 图2. PARP抑制剂 PFS获益一览 PARP抑制剂单药或联合治疗改变了晚期卵巢癌的治疗格局,随着PARP抑制剂试验结果的公布,国内外权威指南一致推荐:PARP抑制剂成为晚期卵巢癌患者一线和铂敏感复发标准维持治疗方案[1,17-21]。 李琎教授点评 卵巢癌易复发,PFS于预测患者的生存结局具有关键作用。PAPR抑制剂的出现在卵巢癌维持治疗中具有里程碑意义。首个获批的PARP抑制剂奥拉帕利开展的系列研究,如STUDY19和后续的SOLO-1、PAOLA-1等,为PARP抑制剂在一线和PSR卵巢癌治疗中的应用提供了坚实的科学基础。特别是SOLO-1研究中BRCAm人群和PAOLA-1研究中HRD亚组的PFS延长,可以说为卵巢癌一线患者带来了希望;L-MOCA研究对亚洲人群,特别是中国患者的积极结果,有望让PSR卵巢癌患者实现长期生存成为现实。 未来,我们期待更多研究能够优化PARP抑制剂的使用,提高患者的生存质量和生存期。 PARP抑制剂维持OS时代:PARP抑制剂再出发,重新定义卵巢癌生存获益 OS被认为是肿瘤药物批准的金标准,是评估药物是否具有临床意义的安全性和有效性的客观指标,PFS的统计学显著改善并不总是意味着OS的改善,因为多种因素可能影响患者进展后生存率,比如药物相关不良反应的发生[5]。 2022年,奥拉帕利首次公布有临床意义的OS结果。SOLO-1研究中,BRCAm人群的7年生存数据更新,奥拉帕利组中位OS仍未达到,7年生存率达67.0%,相较安慰剂死亡风险降低45%;尽管安慰剂组中有超过40%患者接受了随后PARP抑制剂治疗,但奥拉帕利组相比于安慰剂组OS仍有临床获益[22]。(图3) 图3. SOLO-1 : 相比于安慰剂,奥拉帕利一线维持治疗晚期卵巢癌可降低患者死亡风险 同年,PAOLA-1研究的OS结果公布。奥拉帕利联合贝伐珠单抗一线维持治疗HRD阳性患者,奥拉帕利联合贝伐珠单抗OS获益高于贝伐珠单抗单药(5年生存率:65.5% vs 48.4%),中位OS达75.2个月(数据成熟度<50%),高于贝伐珠单抗单药治疗中位OS 57.3个月,与贝伐珠单抗单药相比,奥拉帕利联合贝伐珠单抗的死亡风险降低38%(图4)[13]。进一步的亚组分析显示,无论是否携带BRCA突变,HRD阳性卵巢癌患者接受奥拉帕利联合贝伐珠单抗维持治疗,均有临床意义的OS获益。奥拉帕利因此是目前唯一*在卵巢癌的一线维持治疗领域具有2项临床意义OS获益数据的PAPR抑制剂[23-27]。(图5) 图4. PAOLA-1研究: 奥拉帕利+贝伐一线维持治疗HRD阳性患者,中位OS达75.2个月 图5. PARP抑制剂一线维持治疗PFS与OS临床获益汇总 注:图中数据非来自各PARP抑制剂头对头数据,数据仅供参考 在PSR卵巢癌治疗领域,奥拉帕利的应用同样可以为患者带来OS的延长 [28,29]。 SOLO-2研究指出,对于BRCA1/2突变的PSR卵巢癌患者,在接受含铂化疗后,奥拉帕利单药维持治疗中位OS长达51.7个月,安慰剂组中位OS 为38.8个月(HR=0.74,95% CI 0.54-1.00)。奥拉帕利是目前在 PSR卵巢癌领域的研究中具有临床意义OS获益的PAPR抑制剂。尽管安慰剂组38%的患者出现了后线交叉,奥拉帕利维持治疗仍可延长中位OS达12.9个月(具有临床意义),降低死亡风险26%;校正安慰剂组后线交叉患者数据后,奥拉帕利相比安慰剂,中位OS延长16.3个月,死亡风险降低44%(图6)[28]。后续的OPINION研究表明,对于Non-gBRACm的PSR卵巢癌患者,经奥拉帕利维持治疗,中位OS达32.7个月,24个月和30个月的OS率分别为65.8%和54.9%(图7)29。 图6. SOLO-2研究结果:中期OS数据显示奥拉帕利维持治疗PSR患者,全人群的mOS达到54.4个月 图7. OPINION研究结果:奥拉帕利维持治疗Non-gBRCAm患者,中位OS达32.7个月 L-MOCA研究进一步拓展了奥拉帕利的获益人群。研究发现,奥拉帕利维持治疗PSR 卵巢癌患者,无论患者BRCA突变状态如何,奥拉帕利单药维持治疗均观察到了OS的获益,总体人群中位OS为54.4个月(图8)[30][31]。 图8. L-MOCA研究结果:中期OS数据显示奥拉帕利维持治疗PSR患者,全人群的mOS达到54.4个月 吴小华教授点评 OS是评估肿瘤药物临床意义的关键指标,也是肿瘤药物获批的金标准。奥拉帕利在OS方面的积极结果标志着PARP抑制剂治疗卵巢癌的重要进展。SOLO-1研究的长期数据显示了其在延长生存期方面的效果。PAOLA-1研究进一步证实了奥拉帕利联合贝伐珠单抗在HRD阳性患者中提高生存率的潜力。此外,SOLO-2和OPINION研究强调了奥拉帕利在不同基因背景的PSR患者中延长OS的能力。这些发现为晚期卵巢癌患者的治疗提供了划时代希望,同样证实了奥拉帕利单药或联合的治疗方案在卵巢癌维持治疗方面的地位和疗效。 晚期卵巢癌仍存在巨大的治疗需求。对于抗肿瘤药物,OS仍然是衡量治疗方案效果的金标准。伴随PARP抑制剂研究的不断深入,通过维持治疗给患者带来OS的获益正在成为可能,延长患者的生存时间成为当下卵巢癌治疗追求的主要目标。 PARP抑制剂单药或联合维持治疗改变了晚期卵巢癌的治疗格局,显著延长了晚期卵巢癌患者的PFS,但奥拉帕利的一系列研究使得晚期卵巢癌患者的PFS获益转化为了OS获益,进一步延长患者生存时间。 目前来说,奥拉帕利是唯一*在晚期新诊断卵巢癌和PSR卵巢癌研究中均具有临床意义OS获益的PAPR抑制剂。 *唯一:截止至2024年7月,综合ASCO/ESMO大会公布数据以及用关键词advanced ovarian和PARP抑制剂在PubMed数据库搜索临床研究结果 SOLO1:一项随机、双盲、安慰剂对照的国际多中心的大型临床Ⅲ期研究,纳入391例携带BRCA1/2突变的晚期卵巢癌患者,在含铂化疗后随机接受奥拉帕利300mg bid(N=260)或安慰剂(N=131)治疗,主要终点为研究者评估PFS,研究旨在评价奥拉帕利用于携带BRCA1/2突变的晚期卵巢癌含铂化疗后一线维持治疗的获益。 PAOLA-1研究:一项多国多中心、随机、双盲、3期临床研究,纳入806例一线化疗联合贝伐治疗有反应的新诊断晚期卵巢癌患者,随机分配至接受奥拉帕利300mg bid+贝伐15mg/kg q3w(N=537)或安慰剂+贝伐(N=269)治疗,奥拉帕利或安慰剂的给药持续最长24个月,贝伐给药持续15个月,主要终点为研究者评估的PFS,并由盲法独立中央审查(BICR)进行敏感性分析。 SOLO-2研究:一项随机、双盲、安慰剂对照、多中心的III期临床研究,纳入295例铂敏感复发性卵巢癌且有BRCA1/2突变的患者,随机2:1分配至奥拉帕利300mg bid(N=196)或安慰剂(N=99),主要终点为研究者评估PFS,评估在含铂化疗后达到完全或部分缓解且倒数第二次含铂化疗完成后至疾病复发大于6个月的铂敏感复发性BRCA胚系突变的卵巢癌患者中,奥拉帕利单药维持治疗的疗效。 L-MOCA研究:一项开放、单臂、多中心研究,纳入220例在铂类为基础的化疗后达到完全或部分缓解的铂敏感复发性卵巢癌患者,予奥拉帕利300mg bid治疗,主要终点为研究者评估PFS,评估奥拉帕利单药维持治疗的临床疗效和安全性。该研究是由中国研究者主导的卵巢癌国际多中心研究,主要纳入亚洲人群,其中91.5%为中国患者。 OPINION研究:一项全球性的开放、单臂、多中心IIIb期研究,共纳入16个国家的279名非gBRCAm的铂敏感复发性卵巢癌患者。患者每日接受奥拉帕利600毫克,研究治疗将持续到疾病进展或不可接受的毒性或任何其他协议规定的退出标准出现,主要终点为研究者评估PFS。 参考文献: 1.中国抗癌协会妇科肿瘤专业委员会. 中国实用妇科与产科志. 38.1(2022):56-65. 2.Björkholm E, et al. Acta Radiol Oncol. 1982;21(6):413-419. 3.崔洁, and 杨军文. 齐齐哈尔医学院学报.2021;42(2):147-150. 4.Foster T, et al. Gynecol Oncol. 2009;115(2):290-301. 5.Merino M, et al. J Clin Oncol. 2023 May 20;41(15):2706-2712. 6.李安沣, 等.中国医师杂志.23.12(2021):4. 7.Burger RA, et al. N Engl J Med. 2011;365(26):2473-2483. 8.Tewari KS, et al. J Clin Oncol. 2019;37(26):2317-2328. 9.Perren TJ, et al. N Engl J Med. 2011;365(26):2484-2496. 10.Oza AM, et al. Lancet Oncol. 2015;16(8):928-936. 11.Ledermann JA, et al. N Engl J Med. 2012;366(15):1382-1392. 12.Banerjee S, et al. Lancet Oncol. 2021;22(12):1721-1731. 13.Ray-Coquard I, et al. Ann Oncol. 2023 Aug;34(8):681-692. 14.Pujade-Lauraine E, et al. Lancet Oncol. 2017;18(9):1274-1284. 15.Poveda A, et al. ASCO 2020. Poster No. 228. 16.Gao Q, et al. Clin Cancer Res. 2022;28(11):2278-2285. 17.NCCN Ovarian Cancer including fallopian tube cancer and primary peritoneal cancer(2023.V2) 18.中国抗癌协会妇科肿瘤专业委员会.中国癌症杂志,2021,31(6):490-500. 19.中华医学会妇科肿瘤学分会. 肿瘤综合治疗电子杂志,2022,8(3):64-77. 20.Tew WP, et al. J Clin Oncol. 2022 Nov 20;40(33):3878-3881. 21.González-Martín A,et al. Ann Oncol. 2023 Oct;34(10):833-848. 22.DiSilvestro P, et al. J Clin Oncol. 2022 Sep 9:JCO2201549. 23.González-Martín A, et al. N Engl J Med. 2019;381(25):2391-2402. 24.Li N, et al. SGO 2022. Abstract LBA5. 25.Bradley J Monk, et al. 2022 ASCO No.LBA5500. 26.Xiaohua Wu et al.2023 ESMO, LBA36.25. 27.Wu Lingying. SGO 2024. Poster No. 111 28.Poveda A, et al. Lancet Oncol. 2021;22(5):620-631. 29.Poveda Velasco AM, et al. ESMO 2022. Abstract 531P. 30.Gao Q, et al. ASCO 2024 June 3; #5559. 31.UA. Matulonis, et al. SGO 2023; Oral 06: #161. 32.Wu X, et al. EClinicalMedicine. 2024 May 7;72:102629.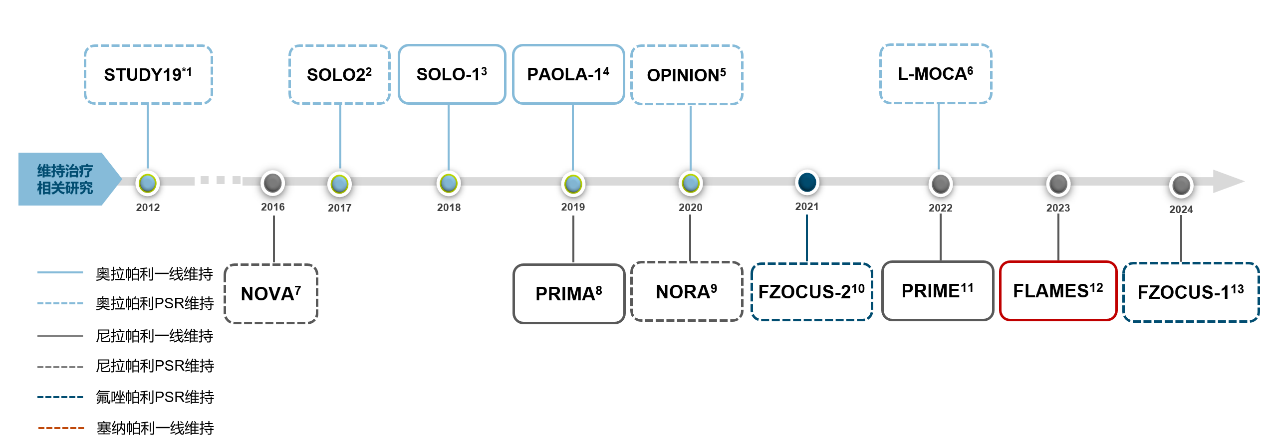


*仅供医学专业人士阅读参考
阅读量:461


