近年来,随着PARP抑制剂广泛用于上皮性卵巢癌临床,多项临床研究证实,其对患者有显著临床获益,PARP抑制剂彻底改变了上皮性卵巢癌诊疗策略。深入探究发现对上皮性卵巢癌患者进行相关的生物标志物检测,有助于指导临床合理用药,改善上皮性卵巢癌患者的PFS。目前,与PARP抑制剂治疗相关的生物分子标志物主要有BRCA1/2基因突变、HRR基因突变、BRCA1/RAD51C启动子甲基化、HRD状态等;其中,BRCA基因突变或HRD是最常用的分子标志物,已获批作为伴随诊断。那么HRR基因突变能否成为下一个指导PARP抑制剂靶向治疗的肿瘤分子标志物?

DNA同源重组修复(HRR)是DNA双链损伤的重要修复方式,是一条涉及到多个步骤的复杂的信号通路,其中关键蛋白为BRCA1和BRCA2。除BRCA1/2外,其他HRR基因突变也可能导致细胞对PARP抑制剂敏感,但不同的HRR基因突变对于PARP抑制剂的敏感性可能不同。由于目前HRR基因突变在上皮性上皮性卵巢癌中的研究证据有限,因此对于其临床意义的解读需要谨慎。
BRCA1/2是重要的抑癌基因,对于维持细胞正常的生长增殖至关重要,也是维持细胞HRR功能最重要的基因。

1.疗效预测:靶向治疗能延长所有上皮性卵巢癌患者无进展生存期。与非突变携带者相比,BRCA突变的上皮性卵巢癌患者对靶向治疗的应答率更高,无进展生存期延长更多。在女性上皮性卵巢癌患者中,BRCA检测也有助于鉴别出对于铂类化疗敏感的BRCA突变患者。
2.预后判断:除诊断分期、组织学检查及手术切除范围之外,BRCA突变情况是的一个重要的预后因子。
3.风险评估:在普通人群中,BRCA检测有助于鉴别罹患上皮性卵巢癌和乳腺癌风险高的女性患者,并且能够帮助这些人群和其家属提前制定预防策略。
同源重组修复缺陷(HRD)意味着DNA双链断裂失去通过同源重组修复对断裂进行修复的能力。在肿瘤细胞内,PARP抑制剂通过抑制PARP酶,并进一步使PARP不能从DNA-PARP复合物中解离出来,从而阻断后续DNA修复过程,进而导致DNA双链断裂。如果患者的HRD状态为阳性,肿瘤细胞无法进行同源重组修复,进一步导致肿瘤细胞死亡。
HRD检测对临床治疗和预后判断具有积极意义
1.治疗指导:上皮性卵巢癌患者治疗方案选择
-
无论是否BRCA突变,HRD检测阳性患者,对单药或联合使用PARP抑制剂均会有更高的药物敏感性和治疗获益。
-
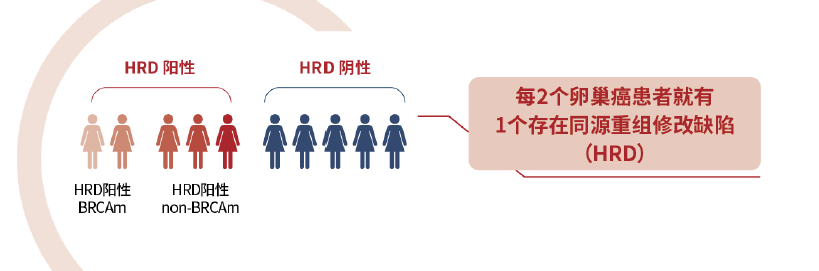
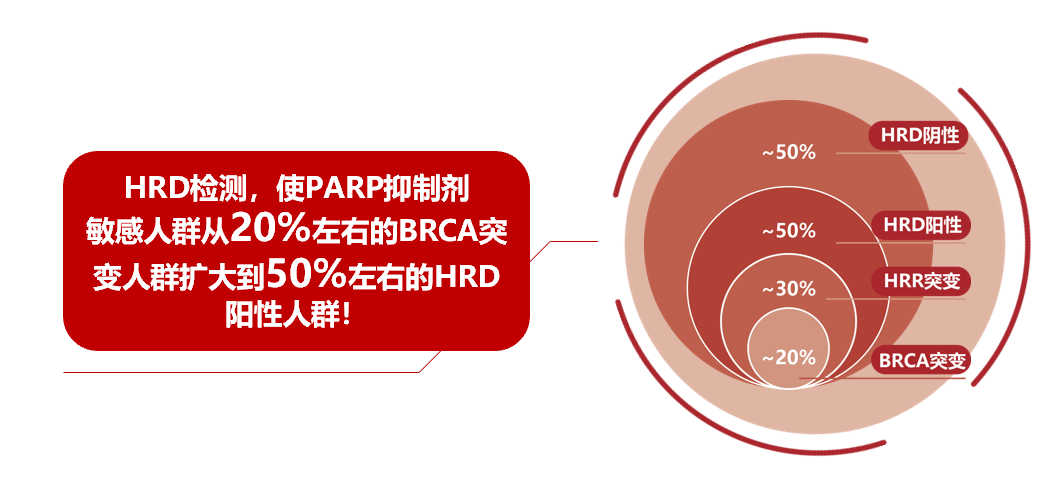
上皮性卵巢癌中,HRD阳性人群占比接近50%,相对占比20%左右的BRCA突变人群,HRD检测扩大PARP抑制剂获益人群,为更多患者争取治疗和生存机会。
2.预后判断:通过对患者进行HRD检测可以从而进一步预测靶向治疗上皮性卵巢癌患者的预后。
2021SGO: HRR检测对上皮性卵巢癌疗效预测的局限性
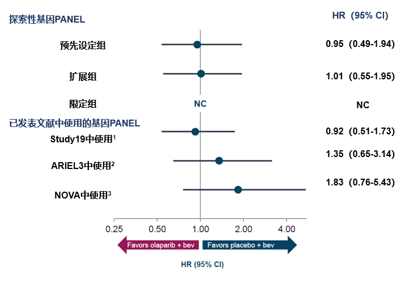
PAOLA-1研究的主要结果已经证实,HRD可以预测奥拉帕利联合贝伐珠单抗 vs 贝伐珠单抗一线维持的疗效(HRD+获益,HRD-不获益)。在2021SGO会议中,Abstract 10543:同源重组修复相关基因突变 (不包括BRCA)不能预测奥拉帕利联合贝伐珠单抗一线维治疗疗效(PAOLA-1 / ENGOT-ov25研究)报道了对HRRm(非BRCA)亚组患者进行研究者评估PFS 的探索性分析,采用了Myriad MyChoice®HRD Plus检测肿瘤组织。
1.PAOLA-1研究中,相比不包括BRCAm的HRD患者(19%),非BRCA突变的HRR突变患者比例较低(3.7%~9.8%)。
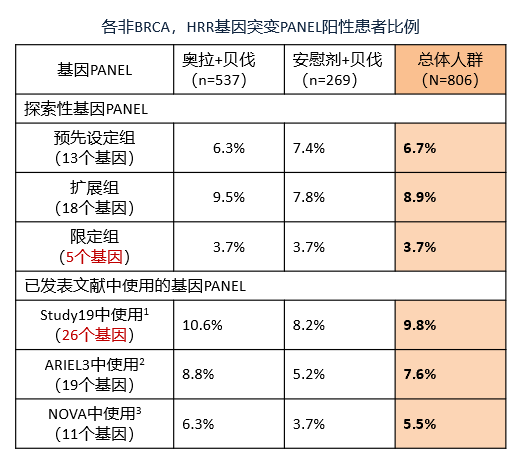
2.无论采用何种基因panel,不论HRR基因panel大小,HRR突变 (不包括BRCA) 均不能预测奥拉+贝伐一线维持疗效。
3.即使在一小部分HRR突变 (不包括BRCA) 人群中,HRD仍可以预测奥拉+贝伐一线维持的获益。
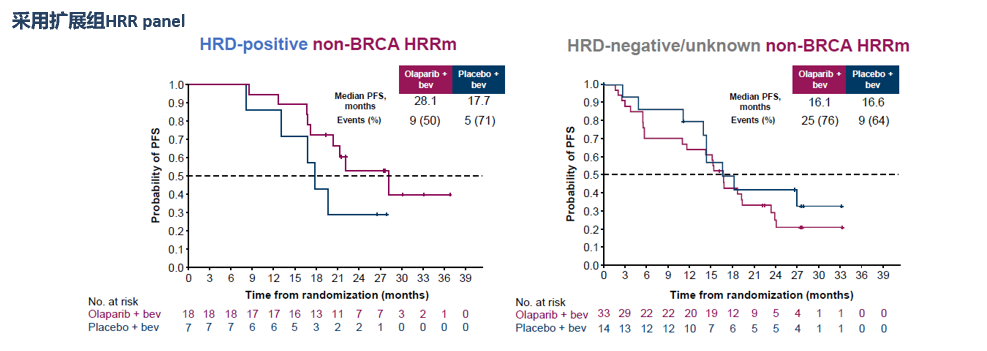
4.基因组不稳定性评分HRD与HRR突变(不包括BRCA)是不可互相替代的。
SGO2021 PAOLA-1研究的数据更新,启示我们:
-
相对于HRD,HRR基因突变(不包括BRCA),并不能预测奥拉+贝伐一线维持的PFS获益;
-
在上皮性卵巢癌一线维持的临床实践中,除BRCA突变外,HRR基因突变和HRD检测不可互相替代;
-
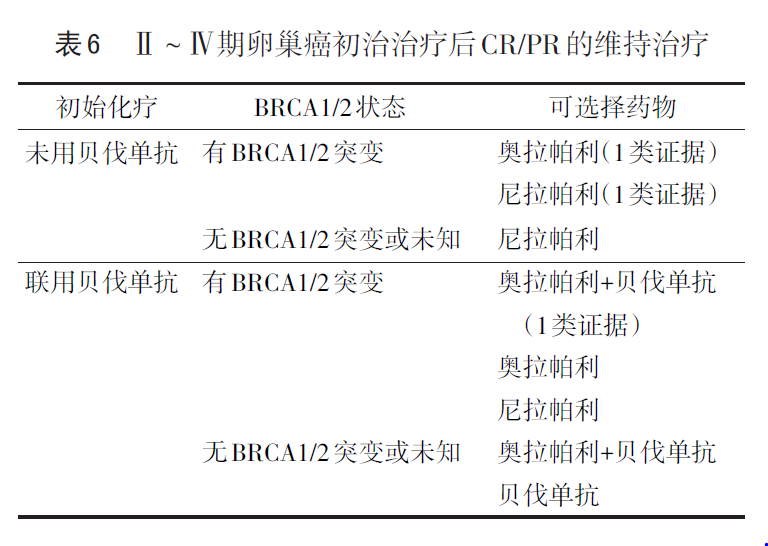
这与目前NCCN指南推荐一致:根据BRCA突变、HRD检测选择相应一线维持方案。
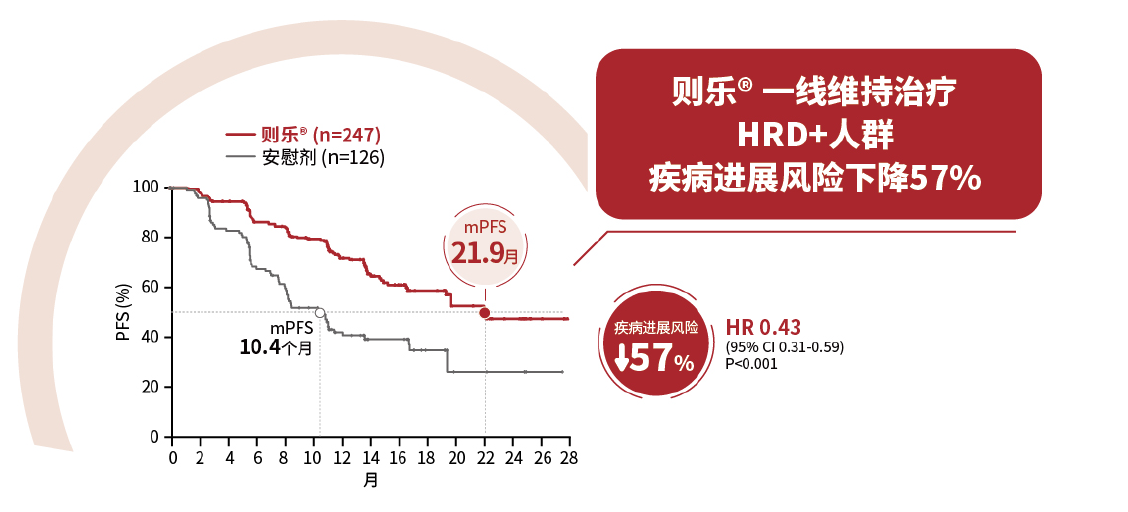
PRIMA研究设计之初,对上皮性卵巢癌患者进行了HRD状态的分层,第一个证实了尼拉帕利用于初治晚期上皮性卵巢癌含铂化疗后一线维持治疗在所有HRD状态亚组中均有明确获益。

HRD阳性人群疾病进展风险下降57% (HRD+人群,无论BRCA状态如何,疾病进展风险均显著下降,BRCAmut疾病展风险下降60%,non-BRCAmut疾病展风险下降50%);HRD阴性疾病进展风险下降32%。无论HRD状态均有临床获益,全人群疾病进展风险下降38%。
全球指南都已推荐上皮性卵巢癌患者考虑HRD检测利于PARP抑制剂疗效预测和预后判断
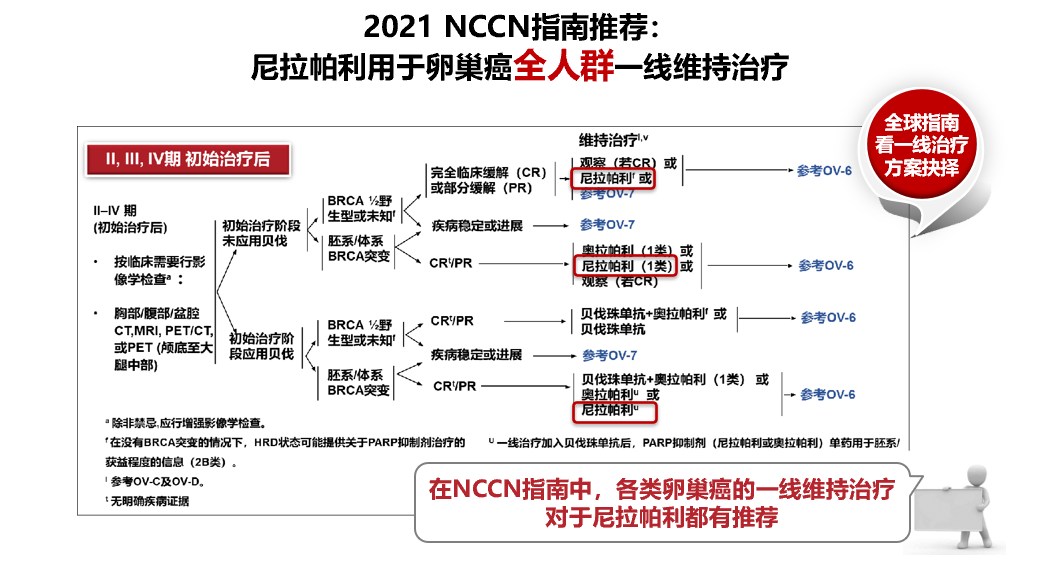
2021NCCN指南推荐不论是初治、还是复发或未控的上皮性卵巢癌患者进行肿瘤分子检测,至少包括BRCA1/2、MSI或dMMR,并考虑HRD检测。目前指南针对不同HRD状态的上皮性卵巢癌的PARP抑制剂推荐,尼拉帕利是唯一推荐用于晚期上皮性卵巢癌全人群一线维持治疗的PARP抑制剂。
HRD检测造福上皮性卵巢癌患者, HRD检测指导临床治疗和判断预后, 使PARP抑制剂敏感人群从20%的BRCA突变人群扩大到50%的HRD阳性人群,助力更多患者赢得最佳治疗,临床获益更多!
HRR≠HRD,HRD检测仍是判断PARP抑制剂一线维持获益与否的金标准
2021SGO发布的研究启示,对于初治卵巢癌患者的一线维持治疗,HRRm(不包含BRCA突变)并不能很好预测PARP抑制剂维持治疗的疗效,所以在临床实践中,HRRm无法作为预测临床疗效的指标,即HRR检测不能用来替代HRD检测。因此,一线卵巢癌患者的精准治疗,BRCA突变、HRD检测是判断PARP抑制剂获益与否的金标准,这与目前全球各大指南的推荐一致。同时,PRIMA研究证实尼拉帕利单药一线维持治疗对HRD阳性患者获益显著,对于HRD阴性的患者人群也有临床获益,延缓疾病进展。
刘开江 医学博士、主任医师、研究生导师。上海交通大学医学院附属仁济医院妇科肿瘤科主任,妇产科副主任、中国抗癌协会妇科肿瘤专业委员会常务委员、中国抗癌协会腔镜与机器人分会常委 、中华医学会妇产科专业委员会内镜学组委员、国家卫计委妇科内镜技术推广专家委员会副主任委员、中国医师协会妇科内镜专业委员会常委、中国医师协会微无创委员会ESRA委员会副主任委员、中国医师协会妇产科分会委员、中国妇幼保健协会妇幼微创专业委员会常委、中国内镜协会妇产科医师分会第三届委员会妇科手术加速康复学组委员、上海市医学会妇科肿瘤分会委员、上海市医学会内镜学组副组长、世界内镜医师协会妇科协会副会长等职。
1.Coleman et al. Lancet2017;390:1949–61
2.Eric Pujade-Lauraine. Homologous recombination repair mutation gene panels (excluding BRCA) are not predictive of maintenance olaparib plus bevacizumab efficacy in the first-line PAOLA-1/ENGOT-ov25 trial. 2021 SGO, abstract 10520.
3. GONZáLEZ-MARTíN A, POTHURI B, VERGOTE I, et al. N Engl J Med, 2019 Sep 28. doi: 10.1056/NEJMoa1910962
4.Gudmundsdottir K, et al. Oncogene 2006;25:5864–74.
5.Hodgson et al. BJC2018;119:1401–09
6.Konstantinopoulos PA, et al. Cancer Discov. 2015;5:1137-1154
7.MARQUARD AM, EKLUND AC, JOSHI T, et al. Pan-cancer analysis of genomic scar signatures associated with homologous recombination deficiency suggests novel indications for existing cancer drugs[J]. Biomark Res, 2015 May 1;3:9. doi: 10.1186/s40364-015-0033-4.
8.Mirza et al. ASCO2019 (abstract 5568)
9.MOORE K, COLOMBO N, SCAMBIA G, et al. N Engl J Med. 2018,379(26):2495-2505.
10.Narod SA, Foulkes WD. Nat Rev Cancer 2004;4:665–76.
11.NCCN Guidelines. Ovarian Cancer: Including Fallopian Tube Cancer and Primary Peritoneal Cancer. 2020 V1
12.RAY-COQUARD I, PAUTIER P, PIGNATA S, et al. Phase III PAOLA-1/ENGOT-ov25 trial: Olaparib plus bevacizumab (bev) as maintenance therapy in patients (pts) with newly diagnosed, advanced ovarian cancer (OC) treated with platinum-based chemotherapy (PCh) plus bev[R]. LBA2_PR presented at ESMO Annual Conference 2019, 27 September - 1 October, Barcelona, Spain.
13.Ray‐Coquard I et al. N Engl J Med. 2019;381:2416–28
14.Rayhaan M M Ali, Stuart A Mclntosh, Kienan I Savage. Homologous recombination deficiency in breast cancer: Implications for risk, cancer development, and therapy. Genes Chromosomes Cancer. 2020 Nov 27. doi: 10.1002/gcc.22921.
15.Sonnenblick A, et al. Nat Rev Clin Oncol. 2015 Jan; 12(1):27-41.
16.Venkitaraman AR. J Cell Sci 2001;114(pt20):3591–8.
17.Watkins JA, Irshad S, Grigoriadis A, Tutt AN. Genomic scars as biomarkers of homologous recombination deficiency and drug response in breast and ovarian cancers. Breast Cancer Res. 2014;16:211
18.上皮性上皮性卵巢癌PARP抑制剂相关生物标志物检测的中国专家共识