邹冬玲教授:则乐单药疗效卓越,双药未来可期!从OVARIO研究看则乐开启卵巢癌一线维持治疗新篇章
时间:2020/9/29 20:42:32 作者:邹冬玲
栏目:研究精读 阅读量:3133

 00:000:00 邹冬玲教授谈从OVARIO研究看卵巢癌一线维持治疗
00:000:00 邹冬玲教授谈从OVARIO研究看卵巢癌一线维持治疗
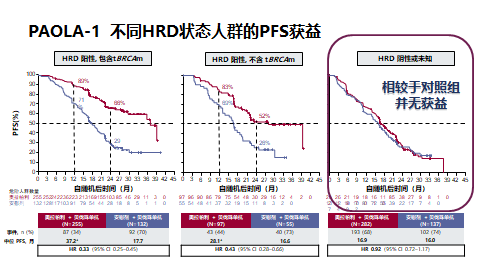
随着两项研究结果的重磅发布,卵巢癌一线维持治疗的方案在2020 NCCN 指南V1版也做出相应调整和修改。在2020年4月,美国食品药品监督管理局(FDA)批准了尼拉帕利单药维持用于一线卵巢癌的患者,且无论生物标志物状态如何。2020年5月8日,FDA批准奥拉帕利联合贝伐单抗用于一线单药维持治疗,仅适用于HRD+晚期卵巢癌患者。
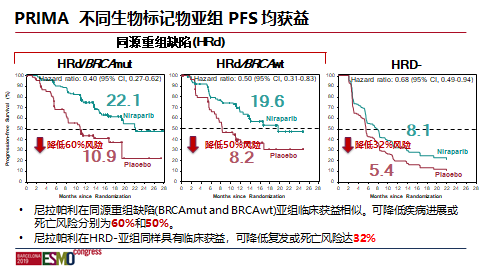
在HRD-人群中,PAOLA-1未证实奥拉帕利联合贝伐珠单抗的双药联合方案较贝伐珠单抗单药有更多的获益,而PRIMA研究已证实了尼拉帕利单药在HRD-人群的PFS获益,再次证明了尼拉帕利单药是对于初治卵巢癌所有人群均能获益的唯一PARPi。那尼拉帕利+贝伐单抗是否可以实现1+1>2的效果?一项关于尼拉帕利联合贝伐单抗用于卵巢癌一线维持治疗的OVARIO研究的中期数据在2020年的SGO大会上公布。OVARIO (NCT03326193)是一项单臂研究,旨在评估晚期卵巢癌患者一线铂类化疗+贝伐珠单抗治疗后,接受尼拉帕利+贝伐珠单抗治疗的效果。
所有新诊断为FIGO分期III期-IV期的卵巢癌患者,在一线铂类化疗+贝伐珠单抗后达到完全缓解或部分缓解(CR或PR)后均符合入组标准。接受新辅助化疗和早期减瘤术的患者均符合入组标准。所有患者在入组时都进行了组织同源重组缺陷检测(HRd或HRp)。贝伐珠单抗的剂量为15 mg/kg,每3周一次,自一线化疗其持续15个月。根据基线体重和血小板计数,在完成一线治疗后12周内开始尼拉帕利治疗,每日一次,每次300或200 mg,持续3年或直到进展性疾病(PD)或不可接受的毒性。主要终点是治疗开始后18个月的PFS。在所有患者开始治疗并进行2次检测后,在开始治疗后6个月时进行中期PFS分析。

OVARIO研究中期数据结果:共105例患者纳入分析。中位年龄为60岁,中位体重68公斤。大多数患者接受新辅助化疗(63%)、III期(79%)、浆液性卵巢癌(95%)。49%的患者有高血压病史,47%的患者携带HRd,包括HRd-BRCA突变和HRd-BRCA野生型。78%患者的初始剂量为200mg。6个月的PFS比例为89.5%。在不良反应方面,联合用药方案的安全性与两种药物作为单药疗法的已知副作用是一致的,并且这种组合并未引起累积毒性,由此说明尼拉帕利是抗血管生成抑制剂的一个联合的优选伙伴。
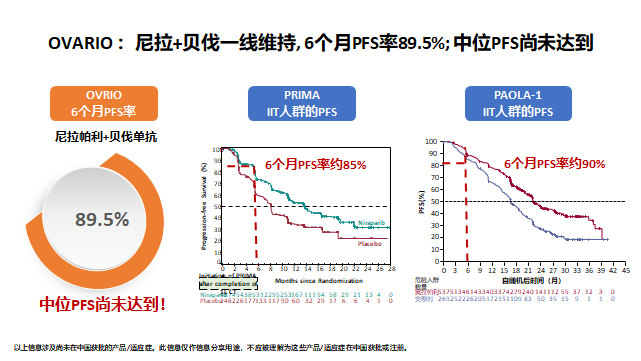
抗血管生产药物-贝伐珠单抗在卵巢癌一线维持治疗的GOG218和ICON7的研究结果并不尽如人意,PFS获益有限而OS无获益。而OVARIO研究结论证实了在一线铂类化疗+贝伐珠单抗的晚期卵巢癌患者中,尼拉帕利+贝伐珠单抗联合用药方案的中位PFS尚未达到,且6个月PFS率与PRIMA、PAOLA-1对比结果接近。在新诊断卵巢癌患者中,化疗中加用贝伐,维持治疗中采用尼拉帕利联合贝伐的方案,提供了一种新选择,尤其对于HRD-以及肿瘤高复发风险人群,可探索联合方案的治疗可行性。

【专家简介】邹冬玲 副主任医师/科主任 医学博士 硕士生导师、任职于重庆市肿瘤医院/重庆大学附属肿瘤医院。
美国希望之城国家医疗中心访问学者,美国辛辛那提大学癌症研究所访问 学者。中国抗癌协会妇科肿瘤专委会常务委员,中国抗癌协会青年理事 会常务理事兼轮值秘书长,中国医促会妇产科分会青年委员会常务副主 委,北京医学奖励基金会妇科肿瘤专家委员会副主任委员,中国青年科技 者协会会员,重庆市医师协会肿瘤医师分会妇科肿瘤临床研究学组组长,中华医学会肿瘤分会青年委员,中国临床肿瘤学会患者教 育专家委员会委员,中国妇幼保健协会妇科肿瘤防治专业委员会委员,中 国研究型医院协会妇科肿瘤专委会青年委员,中国优生科学协会肿瘤生殖 分会委员,北京健康促进会宫颈病变与宫颈癌防治专家委员会委员,重庆 医师协会肿瘤分会委员兼秘书,重庆市青年联合会委员,重庆市卫计委医 学高端后备人才,AJOG中文版青年编委,《中国肿瘤临床》青年编委,《医学参考报》青年编委。
